Bioloģiskās zāles
Bioloģiskās zāles satur bioloģiskas izcelsmes (no cilvēkiem, dzīvniekiem, baktērijām iegūtu) aktīvo vielu (jeb galveno ārstējošo vielu). Lielāko daļu bioloģisko zāļu iegūst ar ģenētiski pārveidotu šūnu palīdzību. Bioloģisko zāļu aktīvās vielas (piemēram, olbaltumvielas jeb proteīni) parasti ir lielākas un sarežģītākas nekā “nebioloģiskas izcelsmes” zāļu aktīvās vielas. Bioloģiskās zāles bieži tiek izmantotas dažādu slimību ārstēšanai.
Plašāka informācija - buklets “Atbildes uz jautājumiem par bioloģiskām zālēm” - pieejams šeit.
Biolīdzinieki
Biolīdzinieks ir bioloģiskās zāles, kuras ir ļoti līdzīgas citām Eiropas Savienībā jau apstiprinātām bioloģiskām zālēm (tā dēvētajām “atsauces zālēm”). Salīdzinot ar atsauces zālēm, biolīdziniekiem var minimāli atšķirties aktīvās vielas kvalitatīvie rādītāji, bet plašos salīdzinošos pētījumos ir pierādīts, ka šīs atšķirības neietekmē biolīdzinieka iedarbīgumu (efektivitāti) un drošumu (blakusparādības). Aktīvās vielas nelielas izmaiņas (piemēram, glikozilēšana) ir pieļaujamas, ja vien olbaltumvielas aminoskābju secība un bioloģiskā aktivitāte ir tāda pati. Ir būtiski zināt, ka nelielas atšķirības aktīvās vielas kvalitatīvajos rādītājos tiek novērotas arī starp vienu un to pašu bioloģisko zāļu (gan atsauces zāļu, gan biolīdzinieka) dažādām sērijām, jo bioloģiskās zāles ražo dzīvi organismi un dabīgs mainīgums ir nenovēršams. Bioloģisko zāļu ražotāji ir ieviesuši stingrus kontroles pasākumus, lai nodrošinātu, ka dabīgais mainīgums neietekmē zāļu iedarbību vai drošumu.
Ņemot vērā aktīvās vielas mainīgumu, biolīdzinieki netiek dēvēti par bioloģisko zāļu ģenēriķiem.
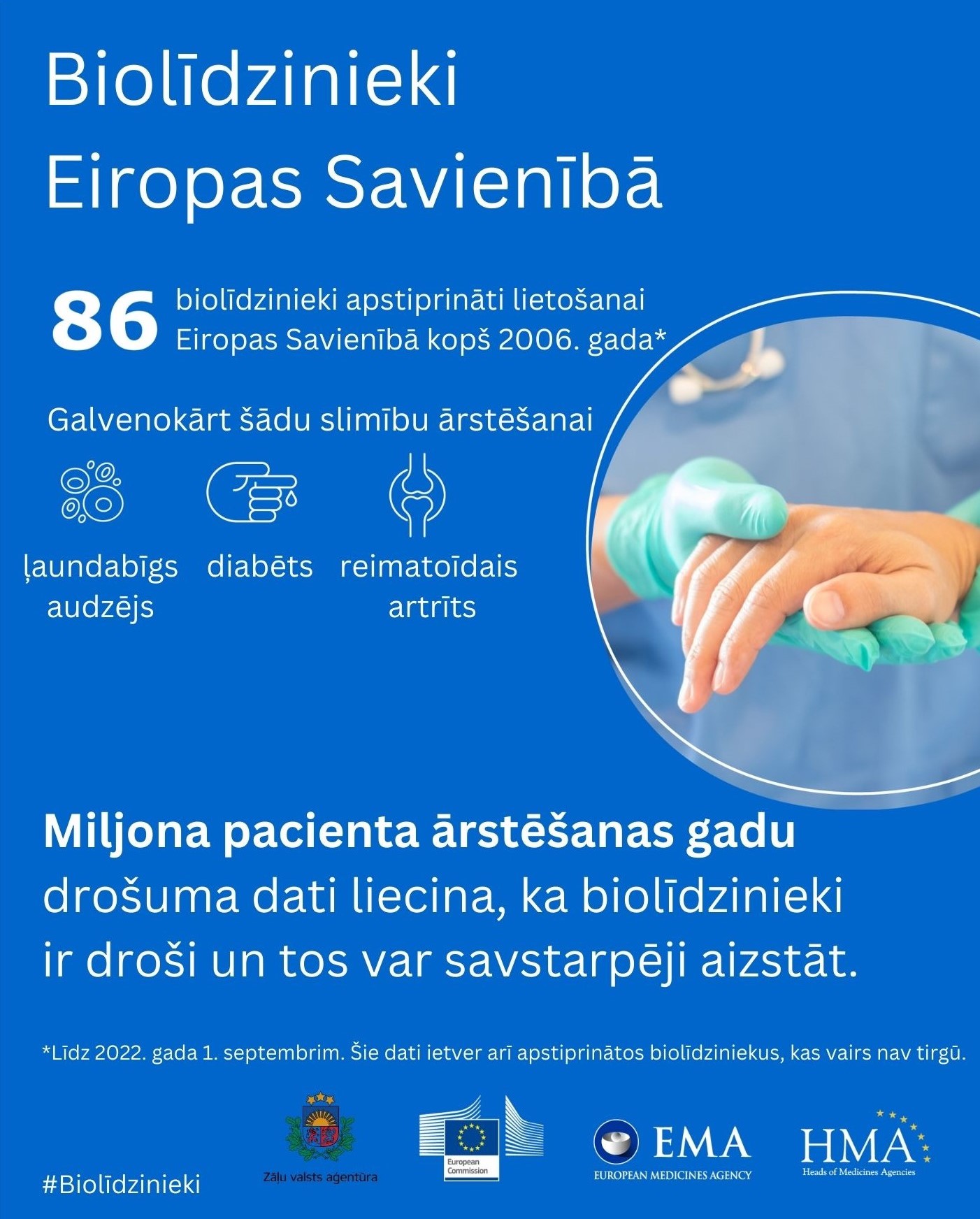
Biolīdzinieki tiek apstiprināti saskaņā ar tādiem pašiem farmaceitiskās kvalitātes, drošuma un iedarbīguma (efektivitātes) standartiem, kas tiek piemēroti visām bioloģiskajām zālēm. Pirmais biolīdzinieks Eiropas Savienībā (ES) tika apstiprināts 2006. gadā (Omnitrope® – atsauces zāļu Genotropin® biolīdzinieks), un līdz 2022. gada 1. septembrim Eiropā bija apstiprināti 86 biolīdzinieki.
Savstarpējā aizstāšana, maiņa un aizvietošana
Savstarpējā aizstāšana nozīmē vienu zāļu aizstāšanu ar citām zālēm, kuru lietošanas gadījumā sagaidāma tāda pati klīniskā iedarbība. Tas var ietvert atsauces zāļu aizstāšanu ar tā biolīdzinieku (vai otrādi) vai viena biolīdzinieka aizstāšanu ar tādu pašu atsauces zāļu citu biolīdzinieku. Ja šādu aizstāšanu veic ārsts, to sauc par maiņu. Ja šāda aizstāšana tiek veikta aptiekā, nekonsultējoties ar zāļu izrakstītāju, to sauc par aizvietošanu.
Līdz šim apkopotie dati no reālās prakses un maiņas pētījumiem liecina, ka “pāriešana” no atsauces bioloģiskajām zālēm uz to biolīdzinieku, no biolīdzinieka uz to pašu atsauces zāļu citu biolīdzinieku un no biolīdzinieka uz tā atsauces zālēm ir droša. Tādēļ Eiropas Zāļu aģentūra atzīst, ka no zinātniskā viedokļa biolīdzinieki ir savstarpēji aizstājami. 2022. gada septembrī Eiropas Zāļu aģentūra (EZA) un Eiropas zāļu aģentūru vadītāji (HMA) ir publicējuši kopīgu paziņojumu, norādot, (ES) ka biolīdziniekus var savstarpēji aizstāt. Ņemot vērā šo informāciju, dalībvalstis veido nacionālās rekomendācijas par dažādu zāļu aizstāšanu un aizvietošanu.
Zāļu drošuma uzraudzība jeb farmakovigilance
Biolīdzinieku drošums tiek uzraudzīts ar tādu pašu zāļu drošuma uzraudzības (farmakovigilances) pasākumu palīdzību kā jebkuru citu zāļu drošums. Nav konkrētu drošuma prasību, kas piemērojamas tikai biolīdziniekiem.
Nākamos divus gadus pēc reģistrācijas apliecības piešķiršanas zāļu drošums un iespējamās blakusparādības tiek rūpīgi uzraudzītas. Par visām iespējamajām zāļu blakusparādībām jāziņo nacionālajai atbildīgajai iestādei (Latvijā – Zāļu valsts aģentūrai). Eiropas Zāļu aģentūra (EZA) izvērtē šos datus, un nepieciešamības gadījumā zāļu lietošanas instrukcijai tiek pievienota jauna informācija. Ir būtiski atzīmēt, ka vairāk nekā 15 gadu laikā, kamēr biolīdzinieki bijuši ES tirgū, tiem nav konstatētas jaunas blakusparādības, kuras jau nebūtu zināmas kā atsauces zāļu blakusparādības. Tas stabili pamato pieņēmumu, ka, tiklīdz biolīdzinieks tiek apstiprināts ES, tas tik tiešām ir klīniski līdzvērtīgs tā atsauces zālēm.
ES reģistrēto zāļu visas iespējamās blakusparādības pieejamas datubāzē EudraVigilance - skatīt šeit.
Informatīvie materiāli sabiedrībai un pacientiem
- Eiropas Zāļu aģentūras (EZA) buklets latviešu valodā: norādījumi pacientiem – pieejams šeit.
- EZA video angļu valodā - pieejams šeit.














