Vērtēšanas rezultāti liecina par cilvēka papilomas vīrusa vakcīnu drošumuCilvēka papilomas vīrusa (CPV) vakcīnu drošuma vērtēšanas rezultāti neapstiprina, ka šīs vakcīnas var izraisīt komplekso reģionālo sāpju sindromu (CRPS) un posturālo ortostatiskās tahikardijas sindromu (POTS). Ziņojumu biežums par CRPS un POTS pēc CPV vakcīnu ievadīšanas neatšķiras no minēto traucējumu biežuma konkrētai vecuma grupai vispārējā populācijā.
Šīs vakcīnas ievadītas vairāk nekā 82 miljoniem meiteņu un sieviešu visā pasaulē, un tās tiek lietotas, lai pasargātu no dzemdes kakla vēža un citām CPV izraisītām slimībām un dažādiem citiem vēža veidu gadījumiem. Dzemdes kakla vēzis ir ceturtais biežākais vēža izraisītas nāves cēlonis sievietēm visā pasaulē. Eiropā ik gadu ir desmitiem tūkstošu nāves gadījumu, lai gan agrīnai vēža atklāšanai tiek lietotas skrīninga programmas. PRAC rūpīgi izvērtēja publicētos pētījumus, klīnisko pētījumu datus un pacientu un veselības aprūpes speciālistu ziņojumus par iespējamām blaknēm, kā arī Eiropas Savienības dalībvalstu sniegtos datus. PRAC secināja, ka pieejamie dati neliecina, ka CPV vakcīnas izraisītu CRPS un POTS, ziņojumu biežums par CRPS un POTS pēc CPV vakcīnu ievadīšanas neatšķiras no minēto traucējumu biežuma konkrētai vecuma grupai vispārējā populācijā. Tādēļ CPV vakcīnu guvums joprojām atsver risku un nav nepieciešams mainīt veidu, kā vakcīnas tiek lietotas, vai veikt pārmaiņas produktu informācijā. Vairāk par šīm zālēm CPV vakcīnas reģistrētas Eiropas Savienībā (ES) ar nosaukumiem “Gardasil/ Silgard”, “Gardasil9” un “Cervarix”. “Gardasil” vakcīna reģistrēta 2006. gada septembrī, un to lieto gan vīriešiem, gan sievietēm vēždraudes veidojumu un vēža novēršanai dzemdes kaklā un anālā kanālā, kā arī dzimumorgānu kārpu novēršanai. Minētās zāles pasargā no 4 CPV tipiem (no 6., 11., 16. un 18. tipa). Vakcīna “Gardasil 9” (reģistrēta 2015. gada jūnijā) tiek lietota līdzīgā nolūkā, un tā pasargā no 9 vīrusa tipiem (no 6., 11., 16., 18., 31., 33., 45., 52. un 58. tipa). Vakcīna “Cervarix” apstiprināta 2007. gada septembrī lietošanai sievietēm un meitenēm, lai novērstu vēždraudes veidojumus un vēzi dzemdes kaklā un dzimumorgānu apvidū, un ārstē 16. un 18. vīrusa tipu. CPV vakcīnas ietvertas daudzu valstu vakcinācijas programmās. Vairāk par šo procedūru CPV vakcīnu vērtēšana sākta pēc Dānijas lūguma saskaņā ar Regulas (EK) Nr. 726/2004 20. pantu. Vērtēšanu veica PRAC, kas atbild par cilvēkiem paredzēto zāļu drošuma jautājumu vērtēšanu, un PRAC sagatavotie ieteikumi tiks pārsūtīti Cilvēkiem paredzēto zāļu komitejai (CHMP) gala lēmuma pieņemšanai. Vērtēšanas procedūras pēdējais solis ir visām ES dalībvalstīm juridiski saistoša lēmuma pieņemšana Eiropas Komisijā.
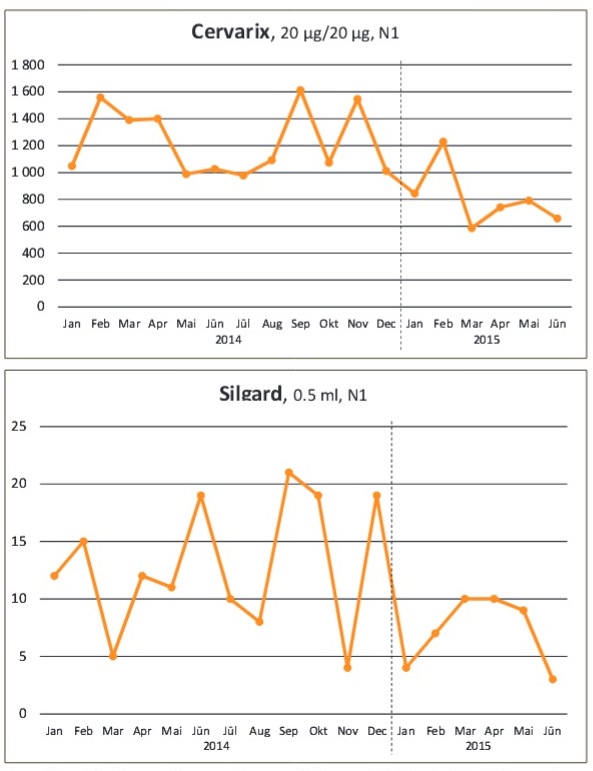
Attēls: Cilvēka papilomas vīrusa vakcīnu patēriņš Latvijā. Datu avots: Zāļu lieltirgotavu iesniegtie zāļu realizācijas pārskati Zāļu valsts aģentūrai. Papildu informācija ir pieejama EMA mājaslapā.
|
Vērtēšanas rezultāti liecina par cilvēka papilomas vīrusa vakcīnu drošumu
05.11.2015.





 Eiropas Zāļu aģentūras (European Medicines Agency jeb EMA) Farmakovigilances riska vērtēšanas komiteja (PRAC) ir pabeigusi zinātnisko pierādījumu vērtēšanu saistībā ar ziņojumiem par diviem veselības traucējumiem – komplekso reģionālo sāpju sindromu (Complex Regional Pain Syndrome), proti, hroniskām sāpēm, kas skar ekstremitātes, un posturālo ortostatiskās tahikardijas sindromu (Postural Orthostatic Tachycardia Syndrome), sirdsdarbības patoloģisku paātrināšanos pēc apsēšanās vai piecelšanās, izraisot tādus simptomus kā reiboni, ģīboni, kā arī galvassāpes, sāpes krūtīs un nespēku – jaunām sievietēm, kuras saņēmušas CPV vakcīnas. Vērtēšana tika veikta, lai precizētu CPV vakcīnu drošumu, un tās rezultāti apstiprināja, ka nepastāv cēloņsakarība starp vakcīnām (Cervarix, Gardasil/ Silgard un Gardasil-9) un CRPS un POTS.
Eiropas Zāļu aģentūras (European Medicines Agency jeb EMA) Farmakovigilances riska vērtēšanas komiteja (PRAC) ir pabeigusi zinātnisko pierādījumu vērtēšanu saistībā ar ziņojumiem par diviem veselības traucējumiem – komplekso reģionālo sāpju sindromu (Complex Regional Pain Syndrome), proti, hroniskām sāpēm, kas skar ekstremitātes, un posturālo ortostatiskās tahikardijas sindromu (Postural Orthostatic Tachycardia Syndrome), sirdsdarbības patoloģisku paātrināšanos pēc apsēšanās vai piecelšanās, izraisot tādus simptomus kā reiboni, ģīboni, kā arī galvassāpes, sāpes krūtīs un nespēku – jaunām sievietēm, kuras saņēmušas CPV vakcīnas. Vērtēšana tika veikta, lai precizētu CPV vakcīnu drošumu, un tās rezultāti apstiprināja, ka nepastāv cēloņsakarība starp vakcīnām (Cervarix, Gardasil/ Silgard un Gardasil-9) un CRPS un POTS.